|
• CARVYKTI®(西达基奥仑赛,cilta-cel)累计治疗患者数已突破10,000例。 • 随着Raritan生产基地完成实体扩建,CARVYKTI®产能进一步提升。该工厂目前是美国规模最大的细胞疗法生产设施。 • 得益于CARVYKTI®营收的持续增长和营业利润率的提升,预计将于2026年实现盈利。 • 体内(in vivo)管线候选药物已在研究者发起的临床试验中完成首例患者给药。 • 来自灵长类动物的临床前数据为非霍奇金淋巴瘤的CD20/CD19双靶点体内CAR-T细胞疗法提供了早期验证。 全球细胞疗法领导者传奇生物科技公司(NASDAQ:LEGN)发布了公司近期的商业化与临床进展,并概述了其2026年的战略优先事项。相关内容将于太平洋时间2026年1月14日(星期三)上午9:00,在加州旧金山举行的第44届摩根大通医疗健康大会上作为公司演示的部分进行讨论。 传奇生物首席执行官黄颖博士表示:"CARVYKTI以其持续突破性的表现,巩固了其在多发性骨髓瘤CAR-T细胞治疗领域无可争议的领先地位,并于今年年初实现了累计治疗超过10,000名患者的里程碑。公司有望在2026年实现变革式增长,我们将通过推动CARVYKTI在全球范围内的应用,力争在今年实现盈利。同时,我们也将致力于利用已经过验证的CAR-T开发平台,拓展至多发性骨髓瘤的前线治疗,并探索极具前景的体内(in vivo)和同种异体(allogeneic)疗法的机遇,以保持我们在细胞治疗创新领域的领导地位。" 2026年 战略优先事项与近期重要进展 巩固CARVYKTI®市场领导地位 Maximize CARVYKTI®Market Leadership • 迄今为止,CARVYKTI®已在临床和商业治疗中惠及超过10,000名患者。 2025年,CARVYKTI®全球业务版图进一步扩大,已在全球14个市场超279家治疗中心供使用。 • 计划在2026年继续推进全球化布局。 • 在美国社区及地区医院的协同下,持续推动CARVYKTI®在社区医疗和门诊渠道中的使用,并促进其在更前线治疗中的渗透。 • 完成了位于Raritan生产厂房的实体扩建,使其成为美国规模最大的细胞疗法生产基地,年产能最高可支持10,000名患者的治疗需求。 • 获得美国食品药品监督管理局(FDA)和欧盟委员会(EC)批准,在CARVYKTI®药品说明书中纳入相较于标准疗法所具有的总生存期获益。 • 此次标签更新基于里程碑意义的3期 CARTITUDE-4研究数据的支持,该研究针对既往接受过一至三线治疗的复发或难治性多发性骨髓瘤(RRMM)患者。 • 在2025年12月举行的第67届美国血液学会(ASH)年会上,公布了来自CARTITUDE-1和CARTITUDE-4研究的最新临床及转化数据,进一步证实了CARVYKTI®的长期获益以及早期使用可改善患者结局。 • 在CARTITUDE-1和CARTITUDE-4试验中,既往接受过三线治疗且三重暴露的患者在单次输注 CARVYKTI®后,中位无疾病进展生存期(PFS)达到 50.4 个月。 • 来自CARTITUDE-1和CARTITUDE-4的其他研究结果表明,在既往接受过一线或二线治疗后较早使用CARVYKTI®治疗的患者,表现出更强的免疫适应性特征及更具免疫活性的肿瘤微环境,这可能是更长无疾病进展生存期的潜在生物学指标。 • 最新的美国国家综合癌症网络(NCCN)指南建议将塔奎托单抗(talquetamab)作为复发或难治性多发性骨髓瘤患者在接受CAR-T治疗前的桥接疗法。该方法有助于确保患者符合CARVYKTI®的治疗条件并改善患者结局,尤其是对于侵袭性疾病患者。 • 2025年8月完成了3期研究 CARTITUDE-6注册临床试验的受试者入组,该研究针对符合移植条件的新诊断多发性骨髓瘤患者。 推进细胞治疗创新 Advance Cell Therapy Innovation • 在第67届美国血液学会(ASH)年会上公布了同种异体CAR-T候选产品LUCAR-G39D的首次人体研试验数据,结果显示出在B细胞非霍奇金淋巴瘤中具有令人鼓舞的安全性及疗效。 • 位于宾夕法尼亚州费城、占地31,000平方英尺的先进细胞治疗研发中心正式启用,将支持公司在肿瘤与免疫学适应症领域及体内(in vivo)疗法的管线扩展。 • 体内平台技术(一种CD20/CD19双靶点细胞疗法)在确定候选药物后的六个月内即完成了首例患者给药。 • 预计将于2026年下半年开始获得首次人体试验数据。 • 计划自2026年下半年开始,针对肿瘤和自身免疫性疾病提交多项临床试验申请(IND)。 驱动盈利能力 Drive Profitability • 预计CARVYKTI®产品线将在2025财年实现盈利。 • 预计公司将在2026年实现整体盈利。 • 截至2025年9月30日,公司持有的现金及现金等价物、定期存款约10亿美元,公司相信该资金储备可提供至2026年以后的运营支持。 传奇生物CEO 黄颖博士 第44届摩根大通医疗健康年会演示安排 黄颖博士将于美国太平洋时间2026年1月14日(星期三)上午9:00在第44届摩根大通医疗健康年会上发表传奇生物的主题演讲。 投资者及感兴趣的人士可通过访问公司官网的"投资者关系"(网址为:investors.legendbiotech.com/events-and-presentations.)观看现场网络直播。直播回放将在直播结束后约48小时内提供。 关于传奇生物 传奇生物(Legend Biotech)是全球最大的独立细胞疗法公司,拥有逾2900名员工,致力于开发能够改变癌症治疗格局的突破性疗法。公司与合作伙伴强生(Johnson & Johnson)共同开发并商业化的CARVYKTI®,是一款用于治疗复发或难治性多发性骨髓瘤的一次性疗法,正引领着CAR-T细胞治疗领域的革命。公司总部位于美国,通过加强领导力建设,构建端到端的细胞治疗体系,以提升CARVYKTI®的患者可及性并充分挖掘其治疗潜力。公司计划以此平台为基础,持续推动其前沿细胞治疗管线中的创新研发。 更多信息请访问legendbiotech.com. 前瞻性说明 本新闻稿中关于未来预期、计划和前景的陈述,以及关于非历史事实事项的任何其他陈述,均构成1995年《私人证券诉讼改革法案》所指的「前瞻性陈述」。这些陈述包括但不限于以下方面的陈述:传奇生物的财务与运营预期,包括其将运营资金维持至2026年的能力、在2026年实现公司整体盈利以及在2025年底前实现与CARVYKTI®相关业务盈利的能力;与CARVYKTI®及LUCAR-G39D相关的陈述,包括传奇生物对CARVYKTI®市场扩展及订单量的预期;公司产品候选物(包括CARVYKTI®及 LUCAR-G39D)的临床前研究与临床试验的时间、进展和结果;以及关于传奇生物产品候选物潜在益处的陈述。诸如「预期」、「相信」、「继续」、「可能」、「估计」、「预计」、「打算」、「或许」、「计划」、「潜力」、「预测」、「项目」、「应该」、「目标」、「将」、「会」和类似表达旨在识别前瞻性陈述,但并非所有前瞻性陈述都包含这些识别词。由于各种重要因素,实际结果可能与此类前瞻性陈述所指的结果存在重大差异。传奇生物的预期可能会受到(包括但不限于)以下因素的影响:新药开发所涉及的不确定性;意外的临床试验结果,包括对现有临床数据或意外的新临床数据进行额外分析的结果;意外的监管行动或延误,包括要求提供额外的安全性和/或有效性数据或数据分析,或政府监管整体环境的变化;因第三方合作伙伴采取的行动或未能采取行动而导致的意外延迟;传奇生物的专利或其他专有知识产权保护受到挑战而产生的不确定性,包括美国诉讼过程中涉及的不确定性;政府、行业和一般产品定价及其他政治压力;以及传奇生物于2025年3月11日向美国证券交易委员会提交的20-F表格年度报告的「风险因素」部分所讨论的其他因素。如果其中一项或多项风险或不确定性成为现实,或基本假设被证明不成立,实际结果可能与本新闻稿中所述的预期、相信、估计或预计的结果存在重大差异。本新闻稿中包含的任何前瞻性陈述仅代表截至本新闻稿发布之日的情况。传奇生物明确声明,无论是由于新信息、未来事件还是其他原因,均不承担更新任何前瞻性陈述的义务。 本新闻稿为中文翻译版,如中英文版本有任何不一致的地方,应以公司官网发布的英文原稿(investors.legendbiotech.com/press-releases/)为准。 媒体联络:PR@legendbiotech.cn 中国首席商业资讯门户;更多内容请关注中国商业网各频道、栏目资讯。 免责声明:凡未注明来自本站的稿件和图片作品,系转载自其它网站,转载目的在于信息传递,并不代表本站赞同其观点和对其真实性负责 。 |

2月25日至26日,作为德国经贸代表团成员之一,福伊特集团首席执行官德克•霍克先生随...
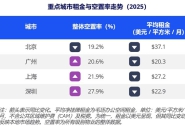
全球领先的多元化专业服务与投资管理公司高力国际(纳斯达克证交所交易代码:CIGI;多...

2026年1月24日至25日,由北京大学电子学院高层培训中心主办的“北京大学2026博雅企业...

2026 年 2 月 10 日,芯天下技术股份有限公司正式在香港联合交易所挂牌上市,股票代码...

当县域经济不再是中国经济的“配角”,而是成为拉动增长的“主力军”,一场关于县域崛...

2026-03-04
2026-03-04
2026-03-04
2026-03-03

